Estadios isotópicos del oxígeno
Nos preguntaremos, ¿qué tienen que ver las matemáticas con los estadios isotópicos del oxígeno? La verdad es que bastante. Sin ellas, hubiese sido imposible interpretar los datos de los que hablaremos a continuación y que arrojan unas conclusiones muy interesantes sobre el pasado del planeta en que vivimos. Comencemos.

Aunque la mayoría de los átomos de un elemento que nos podemos encontrar
en la naturaleza tienen el mismo número de neutrones en el núcleo,
existen lo que se conoce como isótopos. Éstos son átomos, más inestables
que la configuración normal, que difieren en el número de neutrones. En
el caso que nos ocupa, el del oxígeno, la mayoría de los átomos (el
99,762%) se corresponden con el \(^{16}O\). Sin embargo, en la
atmósfera también hay un 0,037% de \(^{17}O\) y un 0,204% de
\(^{18}O\). En un principio, todos tenemos claro lo que es un átomo.
Sin entrar mucho en detalle, está formado por un núcleo formado por
protones y neutrones, alrededor del cual dan vueltas los pequeños
electrones.
Cada elemento queda definido por el número atómico; es decir, los
protones que tiene en el núcleo, que coincide con el número de
electrones en órbita, por eso de que los átomos son neutros
eléctricamente. Y aquí es donde ocurre algo curioso, pero esperable.
Como las moléculas de agua que incluyen átomos ligeros de oxígeno van a
tener más facilidad para evaporarse y, por lo tanto, para caer en forma
de lluvia o nieve, resulta que en las masas de agua dulce y en los
hielos de los casquetes polares vamos a tener una menor proporción de
isótopo pesado \(^{18}O\) en ese agua (0,1981%) que en el aire
(0,204%) o en el agua marina (0,1995%). Esta dependencia permite
analizar los patrones de temperatura.
Los sedimentos marinos (como los de la imagen de portada, que proceden de Groenlandia) constituyen una excelente fuente de información para seguir los cambios de temperatura a lo largo del tiempo. En ellos se van depositando unos pequeños protozoos llamados foraminíferos, cuya concha carbonatada permite establecer la relación entre \(^{18}O\) y \(^{16}O\). Las masas de hielo que se forman durante las glaciaciones son isotópicamente pobres, ya que es el ligero \(^{16}O\) el que más fácilmente se evapora y precipita posteriormente. Así, el agua de mar durante las glaciaciones presenta más \(^{18}O\). Sin embargo, se ha de tener en cuenta que en la formación de las conchas de estos protozoos también influye la temperatura de forma directa, presentando mayores concentraciones de isótopo \(^{18}O\) a temperaturas más bajas. El análisis de estos dos factores permite establecer las etapas isotópicas marinas (marine isotope stages, MIS), anteriormente conocidas como estadios isotópicos del oxígeno (oxygen isotope stages, OIS).
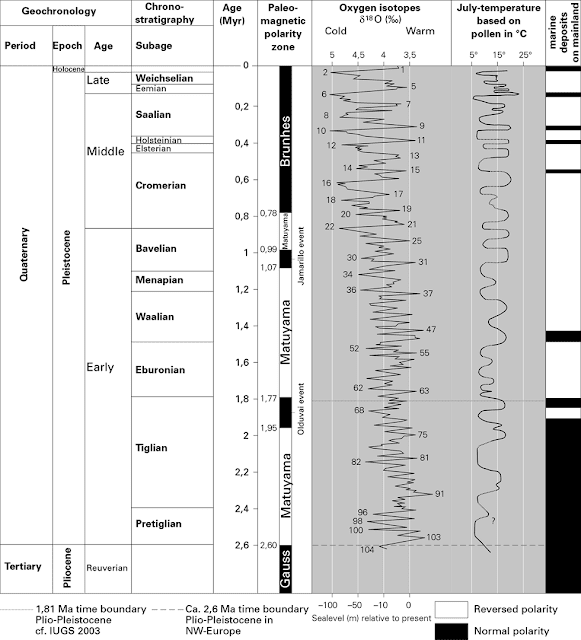
Etapas isotópicas marinas
Las etapas isotópicas marinas son, en correlación con las glaciaciones:
Y aquí dejo la correlación cronoestratigráfica, que se puede descargar a gran calidad (Subcommission on Quaternary Stratigraphy, International Commission on Stratigraphy).

Referencias
http://www.iaea.org/Publications/Magazines/Bulletin/Bull324/Spanish/32406880915_es.pdf
http://en.wikipedia.org/wiki/Marine_isotope_stage
http://en.wikipedia.org/wiki/Paleoclimatology
http://www.geo.uu.nl/fg/palaeogeography/
http://quaternary.stratigraphy.org/charts/
http://en.wikipedia.org/wiki/Timeline_of_glaciation